临床研究团队
在临床试验后期的统计分析阶段,我们都会需要做一件事情,就是做人群划分决议,将临床试验中的所有病例按照条件划入各数据集以进行统计分析。以下就临床试验统计分析的数据集做一简要概述。
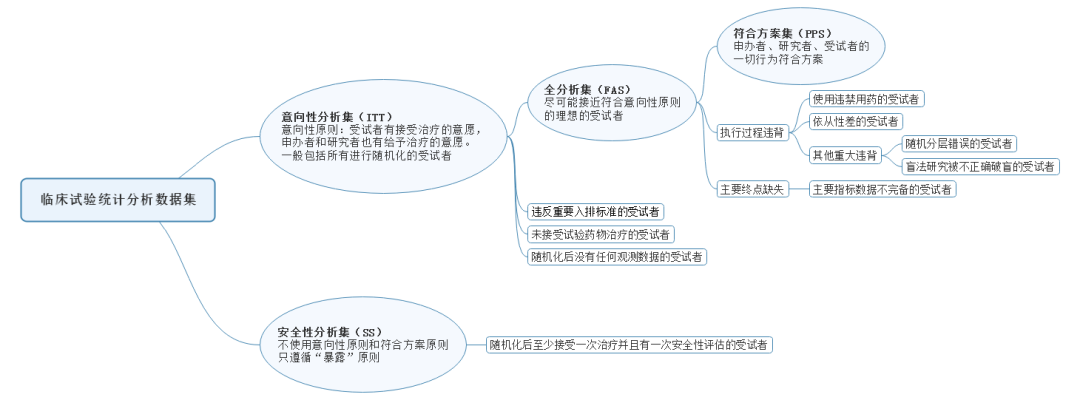
一般情况下,临床试验的统计分析数据集,包括意向性分析集(Intention To Treat Principle,简称ITT)、全分析集(Full Analysis Set,简称FAS)、符合方案集(Per Protocol Set,简称PPS)、安全性分析集(Safety Set,简称SS)。
(Intention To Treat Principle,简称ITT)
按照意向性治疗的原则,通俗来说,就是受试者有接受治疗的意愿,申办者和研究者也有给予治疗的意愿。ITT集通常包含的是所有进行随机化的受试者。
(Full Analysis Set,简称FAS)
由于ITT只是一个理论,接受随机化的受试者不一定用药,或者用药后不一定会有随访数据,所以在剔除了随机化后未用药、以及随机化后没有任何随访数据的受试者后,得到进行统计分析的FAS。通常采用FAS来描述尽可能的完整且尽可能的接近于包括所有随机化受试者的分析集。违反入排标准的受试者,一般会结合方案情况,由数据审核会的形式确定是否剔除出FAS,例如,轻度的安全性指标入排项违背,一般是可以被接受而纳入FAS的;与目标适应症相关的入排项,或显著影响疗效评估的入排项违背,一般是不可被接受而剔除出FAS的。
临床试验确定统计分析集,通常使用两个原则,一个是上述的意向性原则,另一个是符合方案原则,即申办方、研究者、受试者的一切行为符合方案,但实际情况中,完全符合方案的病例比较少,所以我们在确定数据集的过程中,通常可以接受一些轻度的方案违背。符合方案集有时也称“有效病例”,就是按照符合方案原则,从全分析集的受试者中,剔除掉有重大方案违背、使用违禁用药、依从性差及主要指标数据不完备的受试者,从而得到。
(Safety Set,简称SS)
通常包括所有接受过一次研究药物治疗的受试者。安全性分析集不使用上述的意向性原则和符合方案原则,只遵循“暴露”原则。
3.讨
以上是确定统计分析集的通常方法。在实际的临床试验操作过程中,我们用于统计分析的数据集,通常都需要在临床研究方案或者统计分析计划中,按照方案的实际情况进行事先的明确的定义。 盲法研究必须在盲态下确认受试者的所属的数据集 。
所有被剔除出FAS及PPS的受试者,都应当有充分的理由,这个我们通常会在临床试验的《数据审核报告》的人群划分决议模块中,对每一例受试者的数据集归属做划分,并注明原因。
在验证性研究中,同时使用FAS和PPS进行统计分析,是比较恰当的,若两个数据集的结论是一致的,则对研究结果的可信度是有增强作用的,若两个数据集的结论不一致,则应对为何产生差异进行讨论和解释。
《药物临床试验的生物统计学指导原则(2016年第93号通告)》
《ICH临床试验的统计学指导原则(Ⅱ)》
撰稿 丑囡囡 审阅 宋斌

*仅供医疗卫生专业人士阅读









发表评论 取消回复